Белки: строение белков и функции. Биосинтез белка. Структура одного белка определяется Синтез белка происходит в
Белок - это последовательность аминокислот , связанных друг с другом пептидными связями .
Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид ; если от 10 и более аминокислот - полипептид . Полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную структуру, которая называется конформацией, относят к белкам. Стабилизация такой структуры возможна лишь при достижении полипептидами определенной длины (более 40 аминокислот), поэтому белками обычно считают полипептиды молекулярной массой более 5 000 Да. (1Да равен 1/12 изотопа углерода). Только имея определенное пространственное строение (нативную структуру), белок может выполнять свои функции.
Размер белка может измеряться в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius).
Структура белка
Трехмерная структура белка формируется в процессе фолдинга (от англ. folding - «сворачивание»). Трехмерная структура формируется в результате взаимодействия структур более низких уровней.
Выделяют четыре уровня структуры белка:
Первичная структура — последовательность аминокислот в полипептидной цепи .
Вторичная структура — это размещение в пространстве отдельных участков полипептидной цепи.
Ниже приведены самые распространенные типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 аминокислотных остатка. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина , треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушают структуру α-спирали .
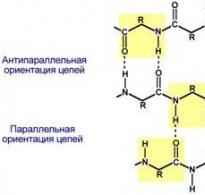
β-складчатые слои — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удаленными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-складчатых слоев важны небольшие размеры боковых групп аминокислот, обычно преобладают глицин и аланин.

Укладка белка в виде β-складчатого слоя
Неупорядоченные структуры - это неупорядоченное расположение белковой цепи в пространстве.
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают как "структурные мотивы". Они имеют специфические названия: "α-спираль-поворот-α-спираль", "структура α/β-бочонка", "лейциновая застёжка-молния", "цинковый палец" и др.
Третичная структура - это способ размещения в пространстве всей полипептидной цепи. Наряду с α-спиралями, β-складчатыми слоями и супервторичными структурами в третичной структуре обнаруживается неупорядоченная конформация, которая может занимать значительную часть молекулы.

Схематичное представление укладки белка в третичную структуру.
Четвертичная структура возникает у белков, которые состоят из нескольких полипептидных цепей (субъединиц, протомеров или мономеров), при объединении третичных структур этих субъдиниц. Например, молекула гемоглобина состоит из 4 субъединиц. Четвертичную структуру имеют надмолекулярные образования - мультиферментные комплексы, которые состоят из нескольких молекул ферментов и коферментов (пируватдегидрогеназа), и изоферменты (лактатдегидрогеназа - ЛДГ , креатинфосфокиназа - КФК).
Итак . Пространственная структура зависит не от длины полипептидной цепи, а от последовательности аминокислотных остатков, специфичной для каждого белка, а также от боковых радикалов, свойственных соответствующим аминокислотам. Пространственную трехмерную структуру или конформацию белковых макромолекул образуют в первую очередь водородные связи, гидрофобные взаимодействия между неполярными боковыми радикалами аминокислот, ионные взаимодействия между противоположно заряженными боковыми группами аминокислотных остатков. Водородные связи играют огромную роль в формировании и поддержании пространственной структуры белковой макромолекулы.
Что касается гидрофобных взаимодействий, то они возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды, которая вытесняется на поверхность белковой глобулы. По мере синтеза белка неполярные химические группировки собираются внутри глобулы, а полярные вытесняются на ее поверхность. Таким образом, белковая молекула может быть нейтральной, заряженной положительно или же отрицательно в зависимости от рН растворителя и ионогенных групп в белке. Кроме того, конформация белков поддерживается ковалентными связями S—S, образующимися между двумя остатками цистеина. В результате образования нативной структуры белка многие атомы, находящиеся на удаленных участках полипептидной цепи, сближаются и, воздействуя друг на друга, приобретают новые свойства, отсутствующие у индивидуальных аминокислот или небольших полипептидов.
Важно понимать, что фолдинг — сворачивание белков (и других биомакромолекул) из развёрнутой конформации в «нативную» форму — физико-химический процесс, в результате которого белки в своей естественной «среде обитания» (растворе, цитоплазме или мембране) приобретают характерные только для них пространственную укладку и функции.
В клетках имеется ряд каталитически неактивных белков, которые тем не менее вносят большой вклад в образование пространственных структур белков. Это так называемые шапероны. Шапероны помогают правильной сборке трехмерной белковой конформации путем образования обратимых нековалентных комплексов с частично свернутой полипептидной цепью, одновременно ингибируя неправильно образованные связи, ведущие к формированию функционально неактивных белковых структур. В перечень функций, свойственных шаперонам, входит защита расплавленных (частично свернутых) глобул от агрегации, а также перенос новосинтезированных белков в различные локусы клеток.
Шапероны преимущественно являются белками теплового шока, синтез которых резко усиливается при стрессовом температурном воздействии, поэтому их называют еще hsp (heat shock proteins). Семейства этих белков найдены в микробных, растительных и животных клетках. Классификация шаперонов основана на их молекулярной массе, которая варьирует от 10 до 90 kDa. Они являются белками-помощниками процессов образования трехмерной структуры белков. Шапероны удерживают новосинтезированную полипептидную цепь в развернутом состоянии, не давая ей свернуться в отличную от нативной форму, и обеспечивают условия для единственно правильной, нативной структуры белка.
В процессе фолдинга белка некоторые конформации молекулы забраковываются на стадии расплавленной глобулы. Деградацию таких молекул инициирует белок убиквитин.
Деградация белка по убиквитиновому пути включает две основные стадии:
1) ковалентное присоединение убиквитина к подлежащему деградации белку через остаток лизина, наличие такой метки в белке является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам, в большинстве случаев к белку присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке.;
2) гидролиз белка протеосомой (основная функция протеасомы - протеолитическая деградация ненужных и повреждённых белков до коротких пептидов). Убиквитин заслуженно называют «меткой смерти» для белка.
Доме?н белка? - элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Белок может иметь несколько доменов, эти участки могут выполнять разные функции в одном и том же белке. Доменную структуру имеют некоторые ферменты и все иммуноглобулины. Белки с длинными полипептидными цепями (более 200 аминокислотных остатков) часто создают доменные структуры.
Химическая структура белков представлена альфа-аминокислотами, соединенными в цепочку посредством пептидной связи. В живых организмах состав определяет генетический код. В процессе синтеза в большинстве случаев применяется 20 аминокислот стандартного типа. Множеством их комбинаций формируются белковые молекулы с самыми разнообразными свойствами. Аминокислотные остатки часто подвергаются посттрансляционным модификациям. Они могут возникнуть и до того, как белок станет выполнять свои функции, и в процессе его активности в клетке. В живых организмах часто несколько молекул формируют сложные комплексы. В качестве примера можно привести фотосинтетическое объединение.
Назначение соединений
Белки считаются важной составляющей питания человека и животных в связи с тем, что в их организмах все необходимые аминокислоты синтезироваться не могут. Часть их должна поступать вместе с белковой пищей. Основными источниками соединений выступают мясо, орехи, молоко, рыба, зерновые. В меньшей степени протеины присутствуют в овощах, грибах и ягодах. При пищеварении посредством ферментов потребленные белки подвергаются разрушению до аминокислот. Они уже используются в биосинтезе собственных протеинов в организме либо подвергаются распаду дальше - для получения энергии.

Историческая справка
Последовательность структуры белка инсулина была определена впервые Фредериеом Сенгером. За свою работу он получил Нобелевскую премию в 1958 году. Сенгер использовал метод секвенирования. С помощью дифракции рентгеновского излучения впоследствии были получены трехмерные структуры миоглобина и гемоглобина (в конце 1950 гг.). Работы проводили Джон Кендрю и Макс Перуц.
Структура молекулы белка
Она включает в себя линейные полимеры. Они, в свою очередь, состоят из остатков альфа-аминокислот, являющихся мономерами. Кроме того, структура белка может включать компоненты, имеющие неаминокислотную природу, и аминокислотные остатки модифицированного типа. При обозначении компонентов применяются 1- либо 3-буквенные сокращения. Соединение, в состав которого входит от двух до нескольких десятков остатков, именуется часто как "полипептид". В результате взаимодействия альфа-карбоксильной группы одной аминокислоты с альфа-аминогруппой другой появляются (в процессе формирования структуры белка) связи. В соединении выделяют С- и N- концы, в зависимости от того, какая группа аминокислотного остатка является свободной: -СООН либо -NH 2 . В процессе синтеза белка на рибосоме в качестве первого концевого выступает, как правило, остаток метионина; присоединение последующих осуществляется к С-концу предыдущих.

Уровни организации
Они были предложены Линдрем-Лангом. Несмотря на то что данное деление считается несколько устаревшим, им все еще пользуются. Было предложено выделять четыре уровня организации соединений. Первичная структура молекулы белка определяется генетическим кодом и особенностями гена. Для более высоких уровней характерно формирование в ходе сворачивания протеина. Пространственная структура белка определяется в целом аминокислотной цепью. Тем не менее она достаточно лабильна. На нее могут оказывать влияние внешние факторы. В связи с этим более корректно говорить о конформации соединения, наиболее выгодной и предпочтительной энергетически.
1 уровень
Он представлен последовательностью аминокислотных остатков полипептидной цепи. Как правило, его описывают с использованием одно- либо трехбуквенных обозначений. Первичная структура белков отличается устойчивыми сочетаниями аминокислотных остатков. Они выполняют определенные задачи. Такие "консервативные мотивы" остаются сохраненными в ходе видовой эволюции. По ним достаточно часто можно предсказывать задачу неизвестного протеина. Оценивая степень сходства (гомологии) в аминокислотных цепях от различных организмов, можно определять эволюционное расстояние, образующееся между таксонами, которые составляют эти организмы. Первичная структура белков определяется методом секвенирования либо по исходному комплексу его мРНК с использованием таблицы генетического кода.

Локальное упорядочивание участка цепи
Это следующий уровень организации - вторичная структура белков. Существует несколько ее типов. Локальное упорядочивание участка цепи полипептида стабилизируется водородными связями. Наиболее популярными типами считаются:

Пространственное строение
Третичная структура белков включает в себя элементы предыдущего уровня. Они стабилизируются разными типами взаимодействий. Важнейшее значение при этом имеют гидрофобные связи. В стабилизации участвуют:
- Ковалентные взаимодействия.
- Ионные связи, формирующиеся между боковыми аминокислотными группами, имеющими противоположные заряды.
- Водородные взаимодействия.
- Гидрофобные связи. В процессе взаимодействия с окружающими элементами Н 2 О происходит сворачивание протеина так, чтобы боковые неполярные аминокислотные группы оказывались изолированными от водного раствора. Гидрофильные группы (полярные) оказываются на поверхности молекулы.
Третичная структура белков определяется методами магнитного (ядерного) резонанса, некоторыми видами микроскопии и прочими способами.
Принцип укладки
Исследования показали, что между 2 и 3 уровнями удобно выделить еще один. Его именуют "архитектурой", "мотивом укладки". Он определяется взаиморасположением компонентов вторичной структуры (бета-тяжей и альфа-спиралей) в границах компактной глобулы - белкового домена. Он может существовать самостоятельно либо быть включенным в состав более крупного протеина вместе с прочими аналогичными. Установлено, что мотивы укладки достаточно консервативны. Они встречаются в протеинах, не обладающих ни эволюционными, ни функциональными связями. Определение архитектуры лежит в основе рациональной (физической) классификации.

Доменная организация
При взаимном расположении нескольких цепей полипептидов в составе одного протеинового комплекса формируется четвертичная структура белков. Элементы, входящие в ее состав, образуются по отдельности на рибосомах. Только по завершении синтеза начинает образовываться данная структура белка. Она может содержать как различающиеся, так и идентичные полипептидные цепи. Четвертичная структура белков стабилизируется за счет тех же взаимодействий, что и на предыдущем уровне. Некоторые комплексы могут включать в себя несколько десятков протеинов.
Структура белка: защитные задачи
Полипептиды цитоскелета, выступая в некотором роде в качестве арматуры, придают многим органоидам форму, участвуют в ее изменении. Структурные протеины обеспечивают защиту организма. К примеру, таким белком является коллаген. Он формирует основу в межклеточном веществе соединительных тканей. Также защитной функцией обладает кератин. Он составляет основу рогов, перьев, волос и прочих производных эпидермиса. При связывании белками токсинов во многих случаях происходит детоксикация последних. Так выполняется задача по химической защите организма. Особенно важную роль в процессе обезвреживания токсинов в человеческом организме играют печеночные ферменты. Они способны расщеплять яды или переводить их в растворимую форму. Это способствует более быстрой транспортировке их из организма. Белки, присутствующие в крови и прочих биологических жидкостях, обеспечивают иммунную защиту, вызывая реакцию как на атаку патогенов, так и на повреждение. Иммуноглобулины (антитела и компоненты системы комплемента) способны нейтрализовывать бактерии, чужеродные протеины и вирусы.
Механизм регуляции
Белковые молекулы, не выступающие ни в качестве источника энергии, ни как строительный материал, контролируют многие внутриклеточные процессы. Так, за счет них осуществляется регулирование трансляции, транскрипции, слайсинга, деятельность прочих полипептидов. Механизм регуляции основывается на ферментативной активности или проявляется благодаря специфичному связыванию с прочими молекулами. К примеру, факторы транскрипции, полипептиды-активаторы и протеины- репрессоры способны контролировать интенсивность генной транскрипции. При этом они взаимодействуют с регуляторными последовательностями генов. Важнейшая роль в контроле над течением внутриклеточных процессов отводится протеинфосфатазам и протеинкиназам. Эти ферменты запускают либо подавляют активность прочих белков посредством присоединения или отщепления от них фосфатных групп.

Сигнальная задача
Ее часто объединяют с регуляторной функцией. Это связано с тем, что многие внутриклеточные, как и внеклеточные, полипептиды могут передавать сигналы. Такой способностью обладают факторы роста, цитокины, гормоны и прочие соединения. Стероиды транспортируются по крови. Взаимодействие гормона с рецептором выступает в качестве сигнала, за счет которого запускается ответная реакция клетки. Стероиды контролируют содержание соединений в крови и клетках, размножение, рост и прочие процессы. В качестве примера можно привести инсулин. Он регулирует уровень глюкозы. Взаимодействие клеток осуществляется посредством сигнальных белковых соединений, передаваемых по межклеточному веществу.
Транспорт элементов
Растворимые протеины, участвующие в перемещении малых молекул, имеют высокое сродство к субстрату, присутствующему в повышенной концентрации. Они обладают также способностью к легкому его высвобождению в областях с низким его содержанием. В качестве примера можно привести транспортный белок гемоглобин. Он перемещает из легких кислород к прочим тканям, а от них - переносит углекислый газ. В транспортировке малых молекул через стенки клетки, изменяя их, участвуют и некоторые мембранные белки. Липидный слой цитоплазмы обладает водонепроницаемостью. Благодаря этому предотвращается диффузия заряженных или полярных молекул. Мембранные транспортные соединения принято разделять на переносчиков и каналы.
Резервные соединения
Эти белки формируют так называемые запасы. Они накапливаются, например, в семенах растений, животных яйцеклетках. Такие белки выступают в качестве резервного источника вещества и энергии. Некоторые соединения используются организмом как аминокислотный резервуар. Они, в свою очередь, являются предшественниками активных веществ, участвующих в регулировании метаболизма.
Клеточные рецепторы
Такие белки могут располагаться как непосредственно в цитоплазме, так и встраиваться в стенку. Одной своей частью соединение принимает сигнал. В качестве него, как правило, выступает химическое вещество, а в ряде случаев - механическое воздействие (растяжение, к примеру), свет и прочие стимулы. В процессе воздействия сигнала на определенный фрагмент молекулы - полипептид-рецептор - начинаются ее конформационные изменения. Они провоцируют смену конформации остальной части, выполняющей передачу стимула на прочие компоненты клетки. Отправка сигнала может осуществляться разными способами. Одни рецепторы способны катализировать химическую реакцию, вторые - выступают в качестве ионных каналов, закрывающихся либо открывающихся под воздействием стимула. Некоторые соединения специфически связывают молекулы-посредники внутри клетки.
Моторные полипептиды
Существует целый класс белков, обеспечивающих движения организма. Моторные белки участвуют в сокращении мышц, перемещении клеток, активности жгутиков и ресничек. За счет них также выполняется направленные и активный транспорт. Кинезины и динеины осуществляют перенос молекул по ходу микротрубочек с использованием в качестве энергетического источника гидролиза АТФ. Вторые перемещают органоиды и прочие элементы по направлению к центросоме из периферических клеточных участков. Кинезины движутся в обратном направлении. Динеины, кроме того, отвечают за активность жгутиков и ресничек.
Белки являются органическими веществами. Эти высокомолекулярные соединения характеризуются определенным составом и при гидролизе распадаются на аминокислоты. Белковые молекулы могут быть самых различных форм, многие из них состоят из нескольких полипептидных цепей. Информация о строении белка закодирована в ДНК, а сам процесс синтеза белковых молекул называется трансляцией.
Химический состав белков
Усредненный белок содержит:
- 52% углерода;
- 7% водорода;
- 12% азота;
- 21% кислорода;
- 3% серы.
Белковые молекулы - это полимеры. Для того чтобы понять их структуру, необходимо узнать, что собой представляют их мономеры - аминокислоты.
Аминокислоты
Их принято делить на две категории: постоянно встречающиеся и иногда встречающиеся. К первым относится 18 и еще 2 амида: аспарагиновой и глутаминовой кислоты. Иногда встречающихся кислот всего три.
Эти кислоты можно классифицировать разными способами: по характеру боковых цепей или заряженности их радикалов, также их можно делить по числу групп CN и COOH.
Первичная структура белка
Порядок чередования аминокислот в белковой цепочке определяет его последующие уровни организации, свойства и функции. Основным между мономерами является пептидная. Она образуется путем отщепления водорода от одной аминокслоты и ОН-группы от другой.
Первый уровень организации белковой молекулы - это последовательность аминокислот в ней, попросту цепочка, которая определяет строение молекул белков. Она состоит из «скелета», имеющего регулярную структуру. Это повторяющаяся последовательность -NH-CH-CO-. Отдельные боковые цепи представлены радикалами аминокислот (R), их свойства определяют состав строения белков.
Даже если строение молекул белков одинаково, они могут отличаться свойствами только от того, что у их мономеров различная последовательность в цепочке. Порядок расположения аминокислот в белке определяется генами и диктует белку определенные биологические функции. Последовательность мономеров в молекулах, отвечающих за одну и ту же функцию, часто близка у разных видов. Такие молекулы - одинаковые или сходные по организации и выполняющие у разных видов организмов одинаковые функции - гомологичные белки. Строение, свойства и функции будущих молекул закладываются уже на этапе синтеза цепочки аминокислот.
Некоторые общие черты
Строение белков было изучено достаточно давно, а анализ их первичной структуры позволил сделать некоторые обобщения. Для большего числа белков характерно присутствие всех двадцати аминокислот, из которых особенно много глицина, аланина, глутамина и мало триптофана, аргинина, метионина, гистидина. Исключениями являются лишь некоторые группы белков, например, гистоны. Они нужны для упаковки ДНК и содержат много гистидина.
Любые виды движения организмов (работа мышц, движение протоплазмы в клетке, мерцание ресничек у простейших и т. д.) осуществляют белки. Строение белков позволяет им двигаться, образовывать волокна и кольца.

Транспортная функция заключается в том, что многие вещества переносятся через клеточную мембрану особыми белками-переносчиками.
Гормональная роль этих полимеров понятна сразу: ряд гормонов по строению являются белками, например инсулин, окситоцин.
Запасная функция определяется тем, что белки способны образовывать отложения. Например, вальгумин яйца, казеин молока, белки семян растений - в них хранится большое количество питательных веществ.
Все сухожилия, суставные сочленения, кости скелета, копыта образованы белками, что подводит нас к очередной их функции - опорной.
Белковые молекулы являются рецепторами, осуществляя избирательное узнавание некоторых веществ. В такой роли особенно известны гликопротеины и лектины.
Важнейшие факторы иммунитета - антитела и по происхождению являются белками. Например, процесс свертывания крови основан на изменениях белка фибриногена. Внутренние стенки пищевода и желудка выстланы защитным слоем слизистых белков - лицинов. Токсины также являются белками по происхождению. Основу кожи, предохраняющей тело животных, составляет коллаген. Все эти функции белков являются защитными.

Ну и последняя по счету функция - регуляторная. Существуют белки, которые управляют работой генома. То есть они регулируют транскрипцию и трансляцию.
Какую бы важную роль ни играли белки, строение белков было разгадано учеными довольно давно. И теперь они открывают все новые пути использования этих знаний.
Биосинтез белка.
1. Структура одного белка определяется:
1)группой генов 2)одним геном
3)одной молекулой ДНК 4)совокупностью генов организма
2. Ген кодирует информацию о последовательности мономеров в молекуле:
1)т-РНК 2) АК 3) гликогена 4) ДНК
3. Антикодонами называются триплеты:
1)ДНК 2) т-РНК 3)и-РНК 4) р-РНК
4. Пластический обмен состоит преимущественно из реакций:
1)распада органических веществ 2)распада неорганических веществ
3)синтеза органических веществ 4)синтеза неорганических веществ
5. Синтез белка в прокариотической клетке происходит:
1)на рибосомах в ядре 2)на рибосомах в цитоплазме 3)в клеточной стенке
4)на внешней поверхности цитоплазматической мембраны
6. Процесс трансляции происходит:
1)в цитоплазме 2)в ядре 3)в митохондриях
4)на мембранах шероховатой эндоплазматической сети
7. На мембранах гранулярной эндоплазматической сети происходит синтез:
1)АТФ; 2)углеводов; 3) липидов; 4)белков.
8. Один триплет кодирует:
1.одну АК 2 один признак организма 3. несколько АК
9. Синтез белка завершается в момент
1.узнавание кодона антикодоном 2.появление на рибосоме «знака препинания»
3.поступление и-РНК на рибосому
10. Процесс, в результате которого происходит считывание информации с молекулы ДНК.
1.трансляция 2.транскрипция 3.трансформация
11. Свойства белков определяется…
1.вторичной структурой белка 2.первичной структурой белка
3.третичной структурой белка
12. Процесс, при котором антикодон узнаёт кодон на и-РНК
13. Этапы биосинтеза белка.
1.транскрипция, трансляция 2.трансформация, трансляция
3.трансорганизация, транскрипция
14. Антикодон т-РНК состоит из нуклеотидов УЦГ. Какой триплет ДНК ему комплементарен ?
1.УУГ 2. ТТЦ 3. ТЦГ
15. Количество т-РНК, участвующих в трансляции, равно количеству:
1.Кодонов и-РНК, шифрующих аминокислоты 2. Молекул и-РНК
3 Генов, входящих в молекулу ДНК 4. Белков, синтезируемых на рибосомах
16. Установите последовательность расположения нуклеотидов и-РНК при транскрипции с одной из цепей ДНК: А-Г-Т-Ц-Г
1) У 2) Г 3) Ц 4) А 5) Ц
17. При репликации молекулы ДНК образуется:
1) нить, распавшаяся на отдельные фрагменты дочерних молекул
2) молекула, состоящая из двух новых цепей ДНК
3) молекула, половина которой состоит из нити иРНК
4) дочерняя молекула, состоящая из одной старой и одной новой цепи ДНК
18. Матрицей для синтеза молекулы иРНК при транскрипции служит:
1) вся молекула ДНК 2) полностью одна из цепей молекулы ДНК
3) участок одной из цепей ДНК
4) в одних случаях одна из цепей молекулы ДНК, в других– вся молекула ДНК.
19.Процесс самоудвоения молекулы ДНК.
1.репликация 2.репарация
3. реанкорнация
20. При биосинтезе белка в клетке энергия АТФ:
1) расходуется 2) запасается
3) не расходуется и не выделяется
21. В соматических клетках многоклеточного организма:
1) различный набор генов и белков 2) одинаковый набор генов и белков
3) одинаковый набор генов, но разный набор белков
4) одинаковый набор белков, но разный набор генов
22.. Один триплет ДНК несет информацию о:
1)последовательности аминокислот в молекуле белка
2)признаке организма 3)аминокислоте в молекуле синтезируемого белка
4)составе молекулы РНК
23. Какой из процессов не происходит в клетках любого строения и функции:
1)синтез белков 2) обмен веществ 3)митоз 4) мейоз
24. Понятие «транскрипция» относится к процессу:
1)удвоения ДНК 2)синтеза и-РНК на ДНК
3)перехода и-РНК на рибосомы 4)создания белковых молекул на полисоме
25. Участок молекулы ДНК, несущий информацию об одной молекуле белка - это:
1)ген 2)фенотип 3)геном 4)генотип
26. Транскрипция у эукариот происходит в:
1)цитоплазме 2)эндоплазматической мембране 3)лизосомах 4)ядре
27.Синтез белка происходит в:
1)гранулярном эндоплазматическом ретикулуме
2)гладком эндоплазматическом ретикулуме 3)ядре 4) лизосомах
28. Одна аминокислота кодируется:
1)четырьмя нуклеотидами 2)двумя нуклеотидами
3)одним нуклеотидом 4) тремя нуклеотидами
29. Триплету нуклеотидов АТЦ в молекуле ДНК будет соответствовать кодон молекулы и-РНК:
1) ТАГ 2) УАГ 3) УТЦ 4) ЦАУ
30. Знаки препинания генетического кода:
1.кодируют определённые белки 2. запускают синтез белка
3. прекращают синтез белка
31. Процесс самоудвоения молекулы ДНК.
1.репликация 2.репарация 3.реанкорнация
32. Функция и-РНК в процессе биосинтеза.
1.хранение наследственной информации 2.транспорт АК на рибосомы
3.подача информации на рибосомы
33. Процесс, когда т-РНК приносят аминокислоты на рибосомы.
1.транскрипция 2.трансляция 3.трансформация
34. Рибосомы, синтезирующие одну и ту же белковую молекулу.
1.хромосома 2.полисома 3.мегахромосома
35. Процесс, при котором аминокислоты образуют белковую молекулу.
1.транскрипция 2.трансляция 3.трансформация
36. К реакциям матричного синтеза относят…
1.репликацию ДНК 2.транскрипцию, трансляцию 3.оба ответа правильные
37.Один триплет ДНК несет информацию о:
1.Последовательности аминокислот в молекуле белка
2.Месте определенной АК в белковой цепи
3.Признаке конкретного организма
4.Аминокислоте, включаемой в белковую цепь
38. В гене закодирована информация о:
1) строении белков, жиров и углеводов 2) первичной структуре белка
3) последовательности нуклеотидов в ДНК
4) последовательности аминокислот в 2-х и более молекулах белков
39. Синтез иРНК начинается с:
1) разъединения ДНК на две нити 2) взаимодействия фермента РНК - полимеразы и гена
3) удвоения гена 4) распада гена на нуклеотиды
40. Транскрипция происходит:
1) в ядре 2) на рибосомах 3) в цитоплазме 4) на каналах гладкой ЭПС
41. Синтез белка не идет на рибосомах у:
1) возбудителя туберкулеза 2) пчелы 3) мухомора 4) бактериофага
42. При трансляции матрицей для сборки полипептидной цепи белка служат:
1) обе цепочки ДНК 2) одна из цепей молекулы ДНК
3) молекула иРНК 4) в одних случаях одна из цепей ДНК, в других– молекула иРНК